Kovalent bağ nedir? Kovalent bağlı bileşikler nelerdir
Güncelleme Tarihi:
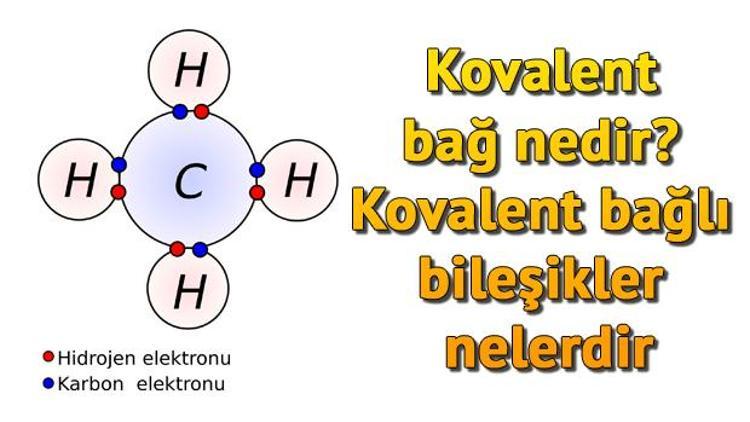
Uzaktan eğitim kapsamında öğrenciler ders konularında geçen terimleri internetten araştırmaya devam ediyorlar. Bunların arasında en çok aranan konulardan biri de 'Kovalent bağ nedir ve Kovalent bağlı bileşikler nelerdir?' sorularının cevapları oluyor. Peki Kovalent bağı nedir?
Kovalent bağ, iki atom arasında, bir veya daha fazla elektronun paylaşılmasıyla karakterize edilen kimyasal bağın bir tanımıdır. Genellikle bağ, ortaya çıkan molekülü bir arada tutan ortak çekim gücü olarak tanımlanabilir. Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu bölgede (-) yüklü bir alan oluşturacaklardır. Bu alan, her iki çekirdeğe bir çekme kuvveti uygulayarak bir bağ oluşturur. Kovalent bağ, Polar Kovalent Bağ ve Apolar Kovalent Bağ olmak üzere ikiye ayrılır.
Kovalent bağ, söz konusu atomların dış yörüngelerinin dolması ile meydana gelir. Bu tür bağlar, moleküller arası hidrojen bağından daima daha güçlü, iyonik bağ ile ise ya aynı güçte ya da daha güçlüdür.
Bazı inorganik maddelerin hidrojen( H), amonyak(NH3),klor(Cl), su(H2O) ve azot(N) molekülleri ile tüm organik maddelerin molekülleri kovalent bağ ile bir arada tutulmaktadır.
Kovalent bağ (iyonik ve metalik bağın tersine) yönlüdür; bağ açılarının etkileşimin gücü üzerinde etkisi büyüktür. Bu etkinin kaynağı, kovalent bağların, atomik yörüngelerin üst üste binmesiyle oluşmasından ileri gelir. Atomik yörüngeler (p, d, ve f orbitalleri) hepsi yönlü karakterde olup, bağlanma esnasında önemli ölçüde yöne bağlı etkileşime neden olurlar.
Kovalent bağ, genellikle benzer elektronegatifliğe sahip atomlar arasında gerçekleşir. Bu nedenle ametaller, daha kolaylıkla kovalent bağı tercih eder ve metaller de kolayca yerlerinden oynatılabilen elektronların daha serbestçe dolaşabildiği metalik bağ yaparlar. Ametallerde bir elektronun serbest kalması daha zordur, dolayısıyla benzer elektronegatifliğe sahip bir madde ile birleşme söz konusu olduğunda o elektronun paylaşılması tek seçenek haline gelir.
Kovalent bağlı bileşikler nedir?
APOLAR KOVALENT BİLEŞİKLER:
Aynı cins ametal atomları arasında olan kovalent bağlı bileşiklerdir. Örnek olarak iki hidrojen atomu arasında oluşan hidrojen molekülünü inceleyelim: Her bir hidrojen atomu 1 elektrona sahiptir. Bu birer elektronun ortaklaşa kullanılmasıyla hidrojen atomları arasında bir bağ meydana gelir. Oluşan molekül H2 molekülüdür.
Hidrojen molekülü; H..H veya H±H şeklinde gösterilir. Birincisi elektron nokta yapısı (Lewis yapısı), ikincisi ise açık formüldür.‡ O2, F2, Cl2, Br 2, I2ve N2 moleküllerinde de apolar kovalent bağ vardır.
POLAR KOVALENT BİLEŞİKLER:
Örnek olarak HF molekülünün oluşumunu inceleyelim: Florun son enerji düzeyinde 7 elektronu, hidrojenin ise 1 elektronu vardır.Hidrojen ve flor arasında bir kovalent bağ oluşur. Florun elektron severliği hidrojenden fazla olduğundan ortaklaşa kullanılan elektronları kendisine daha fazla çekeceğinden kismi negatif yükle, hidrojende kismi pozitif yükle yüklenir.
Başda kutuplanma meydana gelir.‡ Oluşan HF bileşiğidir.‡ H..F elektron nokta yapısıdır.‡ Açık formül H±F şeklinde gösterilir.‡ Molekül doğrusaldır.‡ Farklı cinste ametal atomları arasında oluşan kovalent bağlı bileşiklerdir.‡ HF, HCI, CO, NO molekülleri polar kovalent bileşiklerdir.

